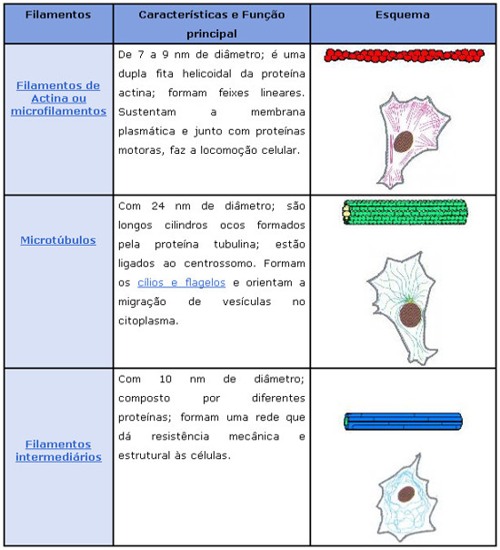
Equação Linear
É toda equação que possui variáveis e apresenta na seguinte forma a1x1 + a2x2 + a3x3 + ...+ anxn = b, em que a1, a2, a3, ....., são os coeficientes reais e o termo independente e representado pelo número real b.
Exemplos:
x + y + z = 20
2x –3y + 5z = 6
4x + 5y – 10z = –3
x – 4y – z = 0
Sistema Linear
Um conjunto de p equações lineares com variáveis x1, x2, x3,....,xn formam um sistema linear com p equações e n incógnitas.
Exemplos:
x + y = 3
x – y = 1
Sistema linear com duas equações e duas variáveis.
2x + 5y – 6z = 24
x – y + 10z = 30
Sistema linear com duas equações e três variáveis.
x + 10y – 12z = 120
4x – 2y – 20z = 60
–x + y + 5z = 10
Sistema linear com três equações e três variáveis.
x – y – z + w = 10
2x + 3y + 5z – 2w = 21
4x – 2y – z + w = 16
Sistema linear com três equações e quatro variáveis.
Solução de um sistema linear
Dado o sistema:
x + y = 3
x – y = 1
Dizemos que a solução deste sistema é o par ordenado (2,1), pois ele satisfaz as duas equações do sistema linear. Observe:
x = 2 e y = 1
2 + 1 = 3 3 = 3
2 – 1 = 1 1 = 1
Dado o sistema:
2x + 2y + 2z = 20
2x – 2y + 2z = 8
2x – 2y – 2z = 0
Podemos dizer que o trio ordenado (5, 3, 2) é solução do sistema, pois ele satisfaz as três equações do sistema linear. Veja:
2 * 5 + 2 * 3 + 2 * 2 = 20 10 + 6 + 4 = 20 20 = 20
2 * 5 – 2 * 3 + 2 * 2 = 8 10 – 6 + 4 = 8 8 = 8
2 * 5 – 2 * 3 – 2 * 2 = 0 10 – 6 – 4 = 0 0 = 0
Classificação de um sistema linear
Todo sistema linear é classificado de acordo com o número de soluções apresentadas por ele.
SPD – Sistema Possível e Determinado – possui apenas uma solução.
SPI – Sistema Possível e Indeterminado – possui infinitas soluções.
SI – Sistema Impossível – não possui solução.
Associando um sistema linear a uma matriz
Um sistema linear pode estar associado a uma matriz, os seus coeficientes ocuparão as linhas e as colunas da matriz, respectivamente. Veja exemplo 1:
O sistema:
x + y = 3
x – y = 1
pode ser representado por duas matrizes, uma completa e outra incompleta.
Matriz completa
É toda equação que possui variáveis e apresenta na seguinte forma a1x1 + a2x2 + a3x3 + ...+ anxn = b, em que a1, a2, a3, ....., são os coeficientes reais e o termo independente e representado pelo número real b.
Exemplos:
x + y + z = 20
2x –3y + 5z = 6
4x + 5y – 10z = –3
x – 4y – z = 0
Sistema Linear
Um conjunto de p equações lineares com variáveis x1, x2, x3,....,xn formam um sistema linear com p equações e n incógnitas.
Exemplos:
x + y = 3
x – y = 1
Sistema linear com duas equações e duas variáveis.
2x + 5y – 6z = 24
x – y + 10z = 30
Sistema linear com duas equações e três variáveis.
x + 10y – 12z = 120
4x – 2y – 20z = 60
–x + y + 5z = 10
Sistema linear com três equações e três variáveis.
x – y – z + w = 10
2x + 3y + 5z – 2w = 21
4x – 2y – z + w = 16
Sistema linear com três equações e quatro variáveis.
Solução de um sistema linear
Dado o sistema:
x + y = 3
x – y = 1
Dizemos que a solução deste sistema é o par ordenado (2,1), pois ele satisfaz as duas equações do sistema linear. Observe:
x = 2 e y = 1
2 + 1 = 3 3 = 3
2 – 1 = 1 1 = 1
Dado o sistema:
2x + 2y + 2z = 20
2x – 2y + 2z = 8
2x – 2y – 2z = 0
Podemos dizer que o trio ordenado (5, 3, 2) é solução do sistema, pois ele satisfaz as três equações do sistema linear. Veja:
2 * 5 + 2 * 3 + 2 * 2 = 20 10 + 6 + 4 = 20 20 = 20
2 * 5 – 2 * 3 + 2 * 2 = 8 10 – 6 + 4 = 8 8 = 8
2 * 5 – 2 * 3 – 2 * 2 = 0 10 – 6 – 4 = 0 0 = 0
Classificação de um sistema linear
Todo sistema linear é classificado de acordo com o número de soluções apresentadas por ele.
SPD – Sistema Possível e Determinado – possui apenas uma solução.
SPI – Sistema Possível e Indeterminado – possui infinitas soluções.
SI – Sistema Impossível – não possui solução.
Associando um sistema linear a uma matriz
Um sistema linear pode estar associado a uma matriz, os seus coeficientes ocuparão as linhas e as colunas da matriz, respectivamente. Veja exemplo 1:
O sistema:
x + y = 3
x – y = 1
pode ser representado por duas matrizes, uma completa e outra incompleta.
Matriz completa
1
|
1
|
3
|
1
|
-1
|
1
|
Matriz incompleta
1
|
1
|
1
|
-1
|
Exemplo 2
x + 10y – 12z = 120
4x – 2y – 20z = 60
–x + y + 5z = 10
Matriz completa
| 1 | 10 | -12 | 120 |
| 4 | -2 | -20 | 60 |
| -1 | 1 | 5 | 10 |
Matriz incompleta
1
|
10
|
-12
|
4
|
-2
|
-20
|
-1
|
1
|
5
|
Obs.: O sistema também pode possuir uma representação matricial. Observe o sistema de equações lineares:
x + 10y – 12z = 120
4x – 2y – 20z = 60
–x + y + 5z = 10
Equação matricial do sistema:

x + 10y – 12z = 120
4x – 2y – 20z = 60
–x + y + 5z = 10
Equação matricial do sistema:

Por Marcos Noé
Graduado em Matemática
Equipe Brasil Escola
Graduado em Matemática
Equipe Brasil Escola
Veja mais!
Classificação de um sistema linear
SPD, SPI e SI.
SPD, SPI e SI.
Sistema Linear Homogêneo
Verificando as soluções de um sistema.
Verificando as soluções de um sistema.